
北京海岸鴻蒙標準物質技術有限責任公司
 白金會員
白金會員 已認證
已認證

北京海岸鴻蒙標準物質技術有限責任公司
 白金會員
白金會員 已認證
已認證
近年來,隨著醫療健康行業的快速發展,藥品質量安全問題引起了社會的廣泛關注。
一、2024年數據統計1、2024年5月22日,浙江省藥品監督管理局發布2024年第1期浙江省藥品質量抽查檢驗公告的通知:浙江省藥品監督管理局組織開展了對轄區內藥品生產、經營和使用單位的相關藥品質量監督抽檢,標示為上海某某金朱藥業生產的1批次利巴韋林注射液和上海某某林州制藥有限公司生產的1批次維生素 B12注射液不符合規定,不符合規定項目為【檢查】可見異物。省藥品監督管理局已要求各相關地市市場監督管理部門依法處置。

2、2024年5月29日,安徽省藥品監督管理局發布2024第5期藥品質量公告:經安徽省宿州市食品藥品檢驗檢測中心檢驗,標示為浙江某某藥業股份有限公司生產的1批次氯化鈉注射液不符合規定,不符合規定項目為【檢查】可見異物。

3、2024年8月5日,上海市藥品監督管理局發布關于2024年第1期藥品質量抽檢通告:上海市藥品監督管理局組織相關單位對本市藥品生產、經營和使用單位開展了藥品質量抽檢,標示為某某健康管理股份有限公司生產的1批次氯化鈉注射液不符合規定,不符合規定項目為【檢查】可見異物。藥品監管部門已要求相關企業采取停售、停用、召回等風險控制措施,并對相關企業依法查處。

4、2024年11月26日,國家藥監局發布關于28批次藥品不符合規定的通告(2024年第51號),經安徽省食品藥品檢驗研究院檢驗,標示為石家莊某某藥業有限公司、江蘇某某藥業有限公司、廣東某某制藥有限公司生產的8批次阿昔洛韋滴眼液不符合規定,不符合規定項目為可見異物。對上述不符合規定藥品,藥品監督管理部門已要求相關企業和單位采取暫停銷售使用、召回等風險控制措施,對不符合規定原因開展調查并切實進行整改。同時,國家藥品監督管理局要求相關省級藥品監督管理部門依據《中華人民共和國藥品管理法》,組織對上述企業和單位存在的涉嫌違法行為立案調查,并按規定公開查處結果。

二、藥品中可見異物問題近5年趨勢
我們看一組數據對比,隨著2019年修訂的《中華人民共和國藥品管理法》全面貫徹落實了“四個最嚴”要求,即最嚴謹的標準、最嚴格的監管、最嚴厲的處罰和最嚴肅的問責,以及《中國藥典》2020年版對可見異物檢測的明確規定,2020年之后,關于藥品中可見異物的改善已經有了顯著的進展,被公告的企業大幅減少。

由此可見,藥品中的可見異物問題是可控的!在藥企和藥品監管部門等相關機構的共同努力下,藥品中的可見異物或將不再見!
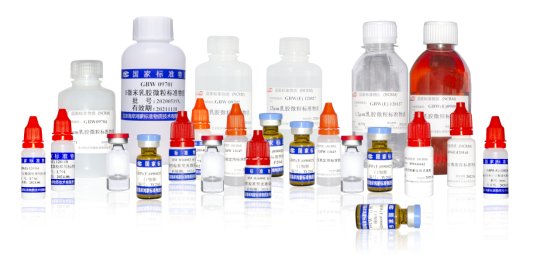
在注射劑企業中,通常使用有證可見異物標準物質或自行制備缺陷品進行質量控制。但從準確性角度看,有證可見異物標準物質經過嚴格的測試和驗證,它們的特性明確,能夠有效幫助檢測人員在實際操作中快速識別異物的類型和特征;從合規性角度看,有證可見異物標準物質是經國家市場監督總局批準的國家標準物質,該產品是用標稱粒徑的單分散聚苯乙烯乳膠微粒,配制成所需濃度的微粒懸浮液。符合《中國藥典2020版:0904可見異物檢查法》的技術要求,采用顯微鏡結合圖像分析法進行定值,結果可溯源至國家長度基準。
有證可見異物標準物質在儀器檢定、儀器質量控制、人員培訓等領域的應用,使檢測結果具備溯源性,不但保證了儀器的可用性,還可評估儀器的適用性,保證了人員目視的準確性,是檢查過程中必備的一環。
三、如何選用合適的可見異物標準物質?
1、首先,看證書。不是所有廠家生產的可見異物標準物質都有國家標準物質定級證書的,目前國內唯一一張證書在北京海岸鴻蒙標準物質技術有限責任公司。

2、可見異物的檢查方法有人工燈檢法和光散射法兩大類。人工燈檢法是各國藥典均采用的檢查方法,光散射法是ChP 0904可見異物檢查法中的第二法,USP<1790>中還介紹了半自動燈檢法和全自動燈檢機法。兩種檢查方法配套的產品有所區別。
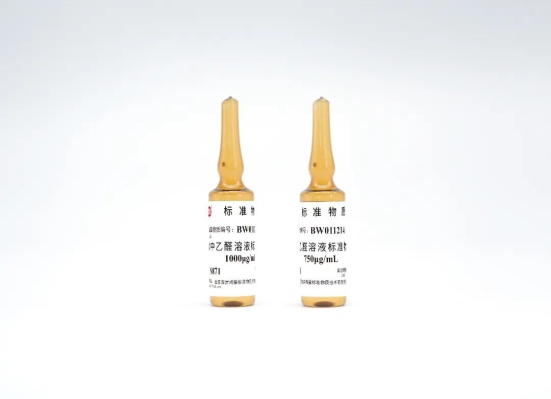
2-1 人工燈檢法用可見異物標準物質
常規包裝為2mL/ 5mL/10mL安瓿瓶或西林瓶。為注射液、眼用液體制劑或其他藥液中可見異物檢查專用標準物質。可用于形式評價和檢驗分析方法,檢測人員培訓和考核。



2-2 全自動燈檢機用可見異物標準物質

符合《JJF1824-2020 全自動燈檢機校準規范》

全自動燈檢機校準用標準物質用標稱粒徑的單分散聚苯乙烯乳膠微粒,配制成所需濃度的微粒懸浮液,包括4種微粒標準物質。完全滿足JJF 1824-2020《全自動燈檢機校準規范》的技術要求。采用顯微鏡結合圖像分析法對顆粒粒徑進行定值,定值結果可溯源至國家長度基準。
本標準物質為250瓶/套,其中80支微粒標準物質,170支空白液,可根據用戶需求制成不同規格與包裝。

3、GMP無菌制劑——Knapp 測試樣品要求及配套方案:


4、可定制特殊材質可見異物

最新動態
更多



虛擬號將在 秒后失效
使用微信掃碼撥號